वर्गीकरण का महत्व - कई तत्वों की खोज हो जाने के पश्चात् अध्ययन की सुविधा के लिए वर्गीकरण आवश्यक हो गया है। समान गुण वाले तत्तों को पास-पास रखना, वर्गीकरण कहलाता है। वर्गीकराण के संदर्भ में समय-समय पर भिन्न-भिन्न वैज्ञानिकों के द्वारा नियम प्रस्तुत किए गए। वर्गीकरण के आधार पर ''किसी वर्ग में उपस्थित तत्वों के गुणों के विषय में अनुमान लगाया जा सकता है।''
प्रारम्भ में तत्वों को धातु एवं अधातु के आधार पर वर्गीकृत किया गया। परन्तु बाद में कुछ ऐसे तत्व पाए गये, जिनके लक्षण धातु तथा अधातु दोनों से पाये गये, जिन्हें उप-धातु कहा गया। इसलिए यह वर्गीकरण असफल रहा।
प्राउट का नियम - प्राउट ने सभी तत्वों को हाइड्रोजन से मिलकर बना माना, लेकिन बाद में कुछ ऐसे तत्व पाये गये जिनका परमाणु भार पूर्णांक में नहीं पाया गया। जैसे - Cl (35.5)
डोेबोराइनर का नियम - इन्होंने 'त्रिक' नियम दिया। इस नियम के अनुसार यदि समान गुण वाले तत्वों को तीन-तीन के समूह में बनाया जाए, तो बीच वाले तत्व का परमाणु भार अन्य दो तत्वों के परमाणु भार का औसत (average) होता है।
उदाहरण - Li → 7, Na → 23, K → 39; औसत - (39+7)/2 = 23.
न्यूलैण्ड का अष्टक नियम - इस नियम के अनुसार यदि तत्वों को परमाणु भार के बढ़ते क्रम में रखा जाए, तो आठवें तत्व का गुण पहले तत्व के गुण के समान होता है। जैसे - संगीत के स्वर में आठवॉं स्वर पहले स्वर के समान होता है।
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| सा | रे | ग | म | प | ध | नि | सा |
| Li | Be | B | C | N | O | F | Na |
 |
| Mendeleev's Periodic Table |
- वर्ग (समूह) -
- मेंडलीफ की आवर्त सारणी में नौ (9) उर्ध्वाधर खाने हैं, जिन्हें वर्ग या समूह कहते हैं। इन वर्गों को एक से नौ तक क्रम नहीं दिया गया है, बल्कि एक से आठ तक दिया गया है। नौवें समूह को शून्य समूह के रूप में शामिल किया गया है, क्योंकि इसकी खोज़ बाद में हुई है।
- शून्य वर्ग एवं आठवें वर्ग को छोड़कर शेष सभी वर्गों को दो उपवर्गों में बॉंटा गया है।
- आठवें वर्ग में तीन-तीन तत्वों को साथ-साथ रखा गया है।
- आवर्त - आवर्त सारणी में क्षैतिज पंक्तियॉं आवर्त कहलाती हैं। मेंडलीफ के आवर्त सारणी में 7 आवर्त हैं। विभिन्न आवर्तों का वर्गीकरण निम्न प्रकार है -
- प्रथम आवर्त में दो तत्व हैं जिसे अति लघु आवर्त कहते हैं।
- दूसरे एवं तीसरे आवर्त में 8-8 तत्व हैं, इन्हें लघु आवर्त कहते हैं।
- चौथे एवं पॉंचवे आवर्त में 18-18 तत्व हैं, इन्हें दीर्घ आवर्त कहते हैं।
- 6वें आवर्त में 32 तत्व हैं, इसे अति दीर्घ आवर्त कहते हैं।
- 7वॉं आवर्त अपूर्ण है, इसमें 19 तत्व हैं।
- प्रत्येक वर्ग की वर्ग संख्या ऑक्सीजन के अनुसार संयोजकता दर्शाती है।
- जिन वर्गों को दो उपवर्गों में विभाजित किया गया है उसके पहले उपवर्ग के सभी तत्वों के गुण लगभग समान होते हैं। परन्तु दूसरे उपवर्ग से इसके गुण सर्वदा भिन्न होते हैं। उदाहरण - वर्ग-I के उपवर्ग A में जो धातुएँ हैं, सभी क्षारीय धातुऍं हैं तथा इनके गुण लगभग समान हैं। इसी प्रकार उपवर्ग B के तत्वों (Cu, Ag, Au) के गुण लगभग समान हैं, परन्तु A एवं B के गुण बिल्कुल भिन्न हैं।
- किसी भी वर्ग के किसी उपवर्ग में ऊपर से नीचे आने पर गुणों में क्रमिक परिवर्तन होता है। जैसे - आकार क्रमश: बढ़ता है, गलनांक क्रमश: घटता है, धन विद्युतीय गुण बढ़ता जाता है आदि।
- गुणों में परिवर्तन - किसी भी आवर्त में बाऍं से दाऍं की ओर चलने पर गुणों में क्रमिक परिवर्तन होता है। जैसे - आकार क्रमश: छोटा होता जाता है, ऑक्साइड गुण में बाऍं से दाऍं चलने पर क्षारीय से अम्लीय गुण होता जाता है।
- संयोजकता में परिवर्तन - किसी भी आवर्त में बाऍं से दाऍं की ओर चलने पर हाइड्रोजन के सापेक्ष एक से चार तक संयोजकता बढ़ती है, तत्पश्चात् क्रमश: घटने लगती है। उदाहरण - NaH, MgH2, AlH3, SiH4.........
- विकर्ण संबंध - दूसरे आवर्त के तत्व, तीसरे आवर्त के विकर्ण में स्थित तत्वों से गुणाें में पर्याप्त समानता रखते हैं। इसे विकर्ण संबंध कहते हैं।
- तत्वों के अध्ययन में सहायक - मेंडलीफ ने अपने आवर्त सारणी में समान गुण वाले तत्वों को एक ही उपवर्ग में रखा। उपवर्ग में ऊपर से नीचे की ओर आने पर गुणों में क्रमिक परिवर्तन होता है, जिसके कारण किसी भी वर्ग के उपवर्ग में उपस्थित तत्वों के अध्ययन में सहायता मिलती है।
- नए तत्वों के खोज में सहायक - मेंडलीफ ने अपने आवर्त सारणी में कुछ तत्वों के लिए स्थान छोड़ दिया था। जैसे - Sc21, Ga31, Ge32 परन्तु इन तत्वों के गुणों के बारे में उन्होंने भविष्यवाणी कर दी थी। बाद में जब ये तत्व खोजे गए तो वे सभी गुण पाए गए जो मेंडलीफ ने भविष्यवाणी की थी।
- तत्वों के परमाणु भार ज्ञात करने में सहायक - परमाणु भार = तुल्यांकी भार x संयोजकता, मेंडलीफ के आवर्त सारणी से हमें किसी भी तत्व की संयोजकता का ज्ञान हो जाता है। संयोजकता का ज्ञान हो जाने के पश्चात् सत्र के द्वारा किसी भी तत्व का परमाणु भार निर्धारित किया जा सकता है। इस प्रकार से यह परमाणु भार ज्ञात करने में सहायक है।
- संदिग्ध परमाणु भार को ठीक करने में - प्रारंभ में बेरेलियम (Be) को त्रि-संयोजी मानकर उसका परमाणु भार 13.5 (4.5x3=13.5) निर्धारित किया गया था, जिसके कारण उसका स्थान कार्बन (C) एवं नाइट्रोजन (N) के मध्य बनता था। परन्तु गणों के आधार पर उसका कोई भी स्थान वहॉं पर नहीं था, परन्तु मेंडलीफ की आवर्त सरणी के द्वारा इसकी 2 संयोजकता ज्ञात हुई। द्विसंयोजी होने के कारण इसका परमाणु भार 9 (4.5x2=9) माना गया। इसके आधार पर इसका स्थान Li एवं B के मध्य दिया गया जोकि पूर्णत: उपयुक्त है।
- हाइड्रोजन का स्थान अनिश्चित - मेंडलीफ अपने आवर्त सारणी में हाइड्रोजन का स्थान निश्चित नहीं कर पाये थे। यह वर्ग - I और वर्ग - VII से, दोनों से समानता रखता है, इसी कारण हाइड्राेजन को आवारा तत्व कहा गया।
- अधिक परमाणु भार वाले तत्वों को कम परमाणु भार वाले तत्वों के पहले रखा जाना - मेंडलीफ ने अपनी आवर्त सारणी में तत्वों को परमाणु भार के बढ़ते क्रम में रखा है। परन्तु कुछ स्थानों पर अधिक परमाणु भार वाले तत्वों को कम परमाणु भार वाले तत्वों के पहले रखा गया है। उदाहरण - Ar(39.9), K(39.1) & Co(58.9), Ni(58.7)
- विभिन्न गुण वाले तत्वों को एक ही वर्ग में रखा जाना - मेंडलीफ ने अपने वर्गाें को A एवं B दो उपवर्गों में विभक्त किया है, जिनके गुण बिल्कुल भिन-भिन्न थे।
- समान गुण वाले तत्वों को अलग - अलग रखा जाना - मेंडलीफ ने अपनी आवर्त सारणी में समान गुण वाले तत्वों, जैसे - Au, Pt तथा Cu, Hg समान गुण वाले तत्वों को अलग-अलग रखा।
- समस्थानिकों का स्थान उपलब्ध न होना - समस्थानिकों का परमाणु भार अलग - अलग होता है तथा मेंडलीफ की आवर्त सारणी परमाणु भार के आधार पर बनायी गयी है, फिर भी इनको समान स्थान नहीं दिया गया है। यह मेंडलीफ की आवर्त सारणी का दोष है।
- असमान गुण वाले तत्वों को एक ही वर्ग में रखा जाना - मेंडलीफ ने अपने आवर्त सारणी में असमान गुण वाले तत्वों को एक ही वर्ग में दो उपवर्ग बनाकर रखा है, जोकि दोषयुक्त है।
- आठवें वर्ग में तीन तत्व एक साथ रखे गये - आठवें वर्ग के पहले सभी वर्गों में A एवं B दो उपवर्ग हैं। परन्तु यह नियम आठवें वर्ग में नहीं लागू किया गया, इसमें तीन-तीन तत्वों को एक साथ रखा गया है।
- दुर्लभ मृदा तत्वों का स्थान उपयुक्त नहीं - 6वें आवर्त में लैंथेनम (La57) के पश्चात् तथा 7वें आवर्त में एक्ट्रीनियम (Ac89) के पश्चात् 14-14 तत्वों को अलग रखा गया है।
आधुनिक आवर्त सारणी में वर्ग तथा आवर्त -
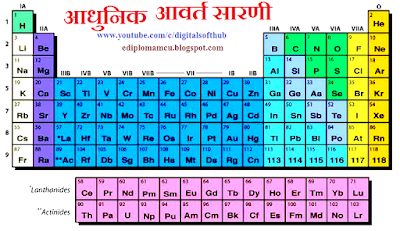 |
| Modern Periodic Table |
- आवर्त वितरण - आधुनिक आवर्त सारणी में 7 क्षैतिज पंक्तियॉं हैं, जिन्हें आवर्त कहते हैं। आवर्त में तत्वों का वितरण निम्न प्रकार है -
- किसी भी तत्व के इलेक्ट्रॉनिक विन्यास में n कोश संख्या आवर्त को प्रदर्शित करता है। यदि n = 2 है, तो इलेक्ट्रॉन दूसरे कोश तक जाएगा और वह दूसरे आवर्त में होगा।
- प्रथम आवर्त को छोड़कर शेष सभी आवर्त क्षार धातुओं से प्रारम्भ होते हैं तथा अक्रिय गैसों में समाप्त होते हैं।
- 6वें आवर्त में La57 (लेंथेनियम परमाणु क्रमांक 57) के पश्चात् 14 तत्वों को अलग रखा गया है, जिन्हें लैंथेनाइट्स कहते हैं तथा Ac89 (एक्टीनियम89) के पश्चात् 14 तत्वों को एक्टिनाइट्स कहते हैं। इन्हें अलग से सारणी में नीचे रखा गया है।
- प्रथम आवर्त - 2, द्वितीय/तृतीय आवर्त - 8,8, चतुर्थ/पंचम आवर्त - 18, 18, छठवां आवर्त - 32, सातवां आवर्त अपूर्ण है।
- वर्ग वितरण - आधुनिक आवर्त सारणी में 18 ऊर्ध्वाधर खाने हैं, जिन्हें वर्ग कहते हैं। वर्ग में तत्वों का वितरण निम्न प्रकार है -
- वर्ग 1, 2, 13, 14, 15, 16, 17, 18 के तत्व प्रसमान्य तत्व या निरूपक तत्व कहलाते हैं।
| वर्ग - 1 | ns1 |
| वर्ग -2 | ns2 |
| वर्ग - 13 | ns2np1 |
| वर्ग - 14 | ns2np2 |
| वर्ग - 15 | ns2np3 |
| वर्ग - 16 | ns2np4 |
| वर्ग - 17 | ns2np5 |
| वर्ग - 18 | ns2np6 |
- वर्ग - III से वर्ग - XII तक के तत्व संक्रमण तत्व कहलाते हैं। इनका सामान्य इलेक्ट्रॉनिक विन्यास (n-1)d1-10 तक होता है।
- वर्ग - III में La57(लेंथेनम-57) के पश्चात् 14 तत्व तथा वर्ग - III में Ac89 (एक्टिनाइट-89) के पश्चात् 14 तत्व अलग रखे गये हैं, जिन्हें दुर्लभ मृदा तत्व कहते हैं। इनमें अन्तिम इलेक्ट्रॉन (n-2)f में जाते हैं।
- आधुनिक परमाणु भार वाले तत्वों को कम परमाणु भार वाले तत्वों के पहले रखा जाना - मेंडलीफ की आवर्त सारणी में जिन तत्वों को पहले रखा गया था तथा उनका परमाणु भार अधिक था (जैसे - 27Co58.93, 28Ni58.69) उनकी व्याख्या में यह बताया गया कि परमाणु क्रमांक कम होने के कारण उन्हें पहले रखा जाना उचित है।
- समस्थानिकों का स्थान - आधुनिक आवर्त सारणी में यह बताया गया है कि तत्वों को परमाणु क्रमांक के आधार पर रखने पर समस्थानिकों का अलग-अलग स्थान नहीं होगा।
- असमान गुण वाले तत्वों को एक ही वर्ग में रखा जाना - मेंडलीफ की आवर्त सारणी में एक ही वर्ग में दो उपवर्ग बनाकर ऐसे तत्वों को रखा गया था, जिनके गुण असमान थे, परन्तु आधुनिक आवर्त सारणी में उपवर्ग A एवं B को अलग-अलग कर दिया।
- उत्कृष्ट गैसों का उपयुक्त स्थान - आधुनिक आवर्त सारणी में उत्कृष्ट गैसों को प्रबल ऋण विद्युतीय एवं प्रबल धन विद्युतीय के मध्य सेतु की तरह रखा गया है। अत: इसका स्थान उपयुक्त है।
- हाइड्रोजन का स्थान निश्चित नहीं हो पाया।
- दुर्लभ मृदा तत्वों की वही स्थिति है, अर्थात् निर्विवाद नहीं हो पाया।
- समान गुण वाले तत्वों को अलग-अलग रखा गया है। Example - Cu एवं Hg तथा Au एवं Pt आदि।
s, p, d, f ब्लॉक का अध्ययन -
- इस ब्लॉक के तत्वों का सामान्य इलेक्ट्रॉनिक विन्यास ns1-2 होता है।
- s - ब्लॉक में दो वर्ग हैं। प्रथम वर्ग को क्षारीय धातुऍं कहते हैं तथा दूसरे वर्ग को क्षारीय मृदा धातुऍं कहते हैं।
- इस ब्लॉक में उपस्थित तत्वों की निश्चित ऑक्सीकरण संख्या होती है। प्रथम वर्ग की ऑक्सीकरण संख्या +1 होती है तथा दूसरे वर्ग की ऑक्सीकरण संख्या +2 होती है।
- हाइड्रोजन को छोड़कर शेष सभी तत्व धातुएँ हैं, जोकि प्रबल धन विद्युतीय एवं अपचायक प्रकृति के होते हैं।
- ये सभी तत्व ज्वाला परीक्षण देते हैं।
- इनके ऑक्साइड क्षारीय होते हैं।
- इस ब्लॉक के तत्व अधिक क्रियाशील होते हैं। जल एवं अम्लों से क्रिया करके H2 मुक्त करते हैं।
- इनका आयनन विभव कम होता है।
- यह विद्युत संयोज्यी यौगिक बनाते हैं।
- इस ब्लॉक के तत्वों का सामान्य इलेक्ट्रॉनिक विन्यास ns2np1-6 (He - अपवाद) होता है।
- p- ब्लॉक में अधिकांश तत्व अधातुऍं हैं। इसके अतिरिक्त कुछ धातुऍं एवं कुछ उप-धातुऍं भी हैं।
- इस ब्लॉक के तत्व सरल आयन एवं जटिल आयन बनाते हैं।
| सरल आयन | जटिल आयन |
| Cl- | SO42- |
| O2- | NO3- |
- इस ब्लॉक के तत्वों के ऑक्साइड सामान्यत: अम्लीय होते हैं, परन्तु कुछ ऑक्साइड (SnO, PbO आदि) उभयधर्मी होते हैं।
- इस ब्लॉक के तत्व आपस में सहसंयोजी बंध बनाते हैं तथा s-ब्लॉक के तत्वों के साथ आयनिक बन्ध बनाते हैं।
- इस ब्लॉक के सभी तत्वों के अन्तिम इलेक्ट्रॉन (n-1)d में जाते हैं। इस प्रकार से इनके अन्तिम एवं उपान्तिम दो कोश अपूर्ण होते हैं। अपवाद (Zn30, Cd48, Hg80)
- इस ब्लॉक के तत्वों के गलनांक उच्च होते हैं। अपवाद (Zn30, Cd48, Hg80)
- ये चुम्बकीय गुण वाले होते हैं।
- ये उत्प्रेरकीय गुण वाले होते हैं।
- इनके द्वारा मिश्र धातुओं का निर्माण होता है।
- इस ब्लॉक के सभी तत्व धातुऍं हैं जिसके कारण इनकी विशेष प्रकार की धात्विक चमक, विशेष प्रकार की ध्वनि, आघातवर्ध्यनीयता, तन्यता के गुण पाए जाते हैं।
- ये ऊष्मा व विद्युत के सुचालक होते हैं।
- इनके ऑक्साइड अम्लीय एवं क्षारीय दोनों लक्षण वाले पाए जाते हैं।
- ये उपसहसंयोजी बन्ध तथा आयनिक बन्ध का निर्माण करते हैं।
- ये परिवर्ती संयोजकता व्यक्त करते हैं। उदाहरण Fe→2, Fe→3
- इस ब्लॉक के तत्वों के अंतिम इलेक्ट्रॉन (n-2)f में जाते हैं।
- ये परिवर्ती संयोजकता व्यक्त करते हैं।
- एक्टिनाइट में रेडियोएक्टिव तत्व उपस्थित होते हैं।
- युरेनियम के पश्चात् सभी तत्व कृत्रिम तत्व हैं, जिन्हें परायूरेनियम तत्व कहते हैं।
- इनके ऑक्साइड सामान्यत: क्षारीय होते हैं।
- इस ब्लॉक के सभी तत्व धातुऍं हैं, जोकि भूपर्पटी (पृथ्वी) में बहुत कम पाये जाते हैं।
- ये चुम्बकीय गुण वाले होते हैं।
- वर्ग में परिवर्तन - किसी वर्ग में ऊपर से नीचे की ओर आने पर काशों की संख्या में वृद्धि होती जाती है, जिसके कारण परमाणु त्रिज्या बढ़ती जाती है।
- आवर्त में परिवर्तन - किसी भी आवर्त में बाऍं से दाऍं की ओर चलने पर त्रिज्या क्रमश: छोटी होती जाती है। इसका कारण यह है कि किसी भी आवर्त में बाऍं से दाऍं की ओर चलने पर परमाणु क्रमांक में वृद्धि के साथ - साथ नाभिकीय आवेश बढ़ता जाता है। नाभिकीय आवेश बढ़ने के कारण संयोजी इलेक्ट्रॉन के प्रति आकर्षण बढ़ता जाता है, जिसके कारण परमाणविक त्रिज्या छोटी होती जाती है।
- नाभिकीय आवेश - किसी परमाणु में नाभिकीय आवेश का मान ज्यादा होने पर परमाणविक त्रिज्या कम होती जाती है।
- कक्षों की संख्या - कक्षों की संख्या बढ़ते जाने पर परमाणविक त्रिज्या बढ़ती जाती है।
- परिरक्षण प्रभाव - परिरक्षण प्रभाव का मान बढ़ने से परमाण्विक त्रिज्या बढ़ती है। (जब किसी परमाणु में अंतिम इलेक्ट्रॉन अंतिम कोश में न जाकर उपान्तिम कोश में प्रवेश करते हैं, तो वह नाभिकीय आवेश को संयोजी कोश तक नहीं पहुॅचने देता है।)
 |
| radius in nucleus |
- नाभिकीय आकर्षण - नाभिकीय आकर्षण का मान बढ़ने पर आयनन ऊर्जा अधिक होता है तथा नाभिकीय आकर्षण कम होने पर आयनन ऊर्जा कम होता है।
- परमाणविक त्रिज्या (परमाणु का आकार) - परमाणु का आकार छोटा होने पर आयनन ऊर्जा अधिक होती है तथा परमाणु का आकार अधिक होने पर आयनन ऊर्जा कम होती है।
- पूर्ण-पूरित या अर्द्ध-पूरित कक्षक - जब किसी परमाणु में अर्द्धपूरित या पूर्णपूरित कक्षक होते हैं, तो उनका आयनन ऊर्जा अधिक होता है, क्योंकि वे अधिक स्थायी होते हैं।
- परिरक्षण प्रभाव - परिरक्षण प्रभाव का मान अधिक होने पर आयनन ऊर्जा कम होती है, क्योंकि परिरक्षण प्रभाव का मान बढ़ने से नाभिकीय आवेश संयोजी इलेक्ट्रॉन तक नहीं पहुॅच पाता है।
- इलेक्ट्रॉनिक आवेश मेघ पर (s, p, d, f कक्षक पर) - s, p, d, f कक्षक भी आयनन ऊर्जा को प्रभावित करते हैं। s - कक्षक से इलेक्ट्रॉन निकालने के लिए p की तुलना में अधिक ऊर्जा व्यय होती है। क्रम - s>p>d>f
- आवर्त में प्रभाव - किसी आवर्त में बाऍं से दाऍं की ओर चलने पर परमाणु का आकार छोटा होता जाता है, जिसके कारण संयोजी कोश में नाभिकीय प्रभाव बढ़ता जाता है, इसलिए इलक्ट्रॉन बन्धुता बढ़ती जाती है।
- वर्ग में प्रभाव - वर्ग में ऊपर से नीचे की ओर आने पर परमाणु का आकार बढ़ता जाता है, परिणामस्वरूप संयोजी कोश पर नाभिकीय प्रभाव घटता जाता है। इसलिए इलेक्ट्रॉन बंधुता घटती जाती है।
- परमाणु का आकार - परमाणु का आकार छोटा होने पर इलेक्ट्रॉन बंधुता अधिक होती है।
- नाभिकीय आकर्षण - नाभिकीय आकर्षण का मान अधिक होने पर इलेक्ट्रॉन बंधुता अधिक होती है।
- इलेक्ट्रॉनिक विन्यास - जब किसी परमाणु का इलेक्ट्रॉनिक विन्यास अर्द्धपूरित या पूर्णपूरित होता है। तब वह स्थायी अवस्था में होता है, ऐसी अवस्था में इलेक्ट्रॉन बन्धुता न्यूनतम होती है। जैसे - अक्रिय गैसों के इलेक्ट्रॉनिक विन्यास में कक्षक पूर्णत: भरे होते हैं। इसलिए आने वाले इलेक्ट्रॉन को स्थान नहीं देते हैं। इसीलिए इनकी इलेक्ट्रॉन बन्धुता शून्य होती है।
- आवर्त में प्रभाव - बाऍं से दाऍं की ओर चलने पर परमाणु का आकार छोटा होता जाता है तथा नाभिकीय आकर्षण बढ़ता जाता है, फलस्वरूप ऋण-विद्युतीय गुण बढ़ता जाता है।
- वर्ग में प्रभाव - किसी वर्ग में ऊपर से नीचे की ओर आने पर परमाणु का आकार बढ़ता है, जिसके कारण नाभिकीय आकर्षण घटता जाता है। अत: ऋणविद्युतीय गण भी घटता जाता है।
- परमाणु का आकार - छोटे आकार के परमाणु में ऋण विद्युती लक्षण ज्यादा होते है।
- नाभिकीय आकर्षण - नाभिकीय आकर्षण का मान अधिक होने पर ऋणविद्युती लक्षण अधिक होता है।
- ऑक्सीकारण गुण - ऑक्सीकारक क्षमता अधिक होने पर ऋण विद्युती लक्षण अधिक होता है।
- आवर्त में - किसी आवर्त में बाऍं से दाऍं की ओर चलने पर s एवं p ब्लॉक के तत्वों में संयोजकता एक से चार तक बढ़ती है, तत्पश्चात घटने लगती है।
- वर्ग में - किसी वर्ग में सामान्यतया संयोजकता समान होती है।
लेखक अभिषेक कुमार त्रिपाठी मध्यप्रदेश बोर्ड से कक्षा-12वी में 2014 में 90.60 प्रतिशत के साथ गणित विज्ञान संकाय से उत्तीर्ण हैं। कोई प्रश्न है या सुझाव है, तो कृपया टिप्पणी दें। यदि आप हमसे सम्पर्क करना चाहते हैं तो ऑफिसियल सेक्शन में जाकर ईमेल आईडी के माध्यम से, या सबसे ऊपर प्रदर्शित नम्बर के माध्यम से व्हाट्सएप के माध्यम से सम्पर्क कर सकते हैं।

No comments:
Post a Comment